衡陽(yáng)市中心醫(yī)院
臨床試驗(yàn)倫理委員會(huì)章程
第一章 總 則
第一條 為保護(hù)臨床研究受試者的權(quán)益和安全,規(guī)范本倫理委員會(huì)的組織和運(yùn)作�,根據(jù)國(guó)家藥品監(jiān)督管理局《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(2020年)、《赫爾辛基宣言》����、國(guó)際醫(yī)學(xué)科學(xué)組織理事會(huì)《涉及人的生物醫(yī)學(xué)研究國(guó)際倫理準(zhǔn)則》、《臨床試驗(yàn)倫理審查工作指導(dǎo)原則》(2010年)和《涉及人的生物醫(yī)學(xué)研究倫理審查辦法》(2016年)等法律��、法規(guī)和有關(guān)部門(mén)的要求制定本章程��。
第二條 衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)的宗旨是通過(guò)對(duì)臨床研究項(xiàng)目的科學(xué)性�����、倫理合理性進(jìn)行審查��,確保受試者尊嚴(yán)���、安全和權(quán)益得到保護(hù)����,促進(jìn)生物醫(yī)學(xué)研究達(dá)到科學(xué)和倫理的高標(biāo)準(zhǔn)��,增強(qiáng)公眾對(duì)臨床研究的信任和支持。
第二章 組織
第三條 本倫理委員會(huì)名稱:衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)�����。
第四條 地址:湖南省衡陽(yáng)市雁峰區(qū)雁城路10號(hào)��。
第五條 組織架構(gòu)圖如下:
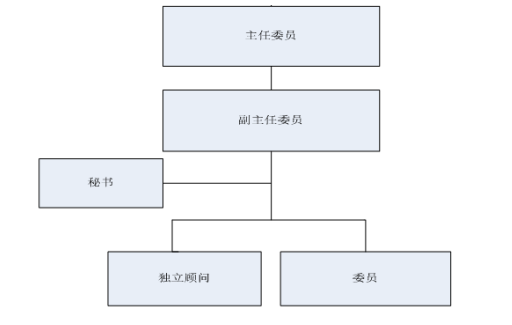
第六條 職責(zé)
倫理委員會(huì)應(yīng)根據(jù)倫理審查工作的需要不斷完善組織管理和制度建設(shè)��,履行保護(hù)受試者的安全和權(quán)益的職責(zé)���。其職責(zé)的履行通過(guò)對(duì)申請(qǐng)人提交的藥物臨床試驗(yàn)項(xiàng)目的倫理問(wèn)題進(jìn)行獨(dú)立��、公正��、公平和及時(shí)審查來(lái)實(shí)現(xiàn)。主要包括:初始審查�、跟蹤審查和快審。
第七條 權(quán)力:
倫理委員會(huì)對(duì)藥物臨床試驗(yàn)進(jìn)行審查監(jiān)督可以行使如下權(quán)力:
(一)批準(zhǔn)/不批準(zhǔn)一項(xiàng)藥物臨床試驗(yàn)�����;
(二)對(duì)批準(zhǔn)的臨床試驗(yàn)進(jìn)行跟蹤審查�;
(三)終止或暫停已經(jīng)批準(zhǔn)的臨床試驗(yàn)。
第八條 行政資源:
倫理委員會(huì)的工作需要醫(yī)院的行政資源支持�,包括:
(一) 獨(dú)立的行政匯報(bào)關(guān)系����,不受行政級(jí)別以及任何研究人員的影響開(kāi)展獨(dú)立公正的倫理審核����。獨(dú)立指獨(dú)立于所審查的項(xiàng)目,與項(xiàng)目利益相關(guān)的倫理委員會(huì)人員應(yīng)避免利益沖突���,醫(yī)院行政領(lǐng)導(dǎo)不得通過(guò)行政手段干預(yù)倫理委員會(huì)的工作����。
(二) 從行政上確保倫理委員成員有足夠的時(shí)間和精力參與倫理委員會(huì)工作�����。
(三) 倫理委員會(huì)的決議必須能貫徹實(shí)施�����,研究人員不得違反倫理委員會(huì)規(guī)定開(kāi)展相關(guān)臨床試驗(yàn)工作����。
第九條 財(cái)政資源:
倫理委員會(huì)為非營(yíng)利性機(jī)構(gòu),醫(yī)院在財(cái)政上提供相應(yīng)的資助。財(cái)政來(lái)源可以是醫(yī)院的撥款已經(jīng)被審查項(xiàng)目提交的倫理審查費(fèi)����。
倫理委員會(huì)的所有收入不得挪做他用,只能用于倫理委員會(huì)自身的建設(shè)發(fā)展(如委員的培訓(xùn)�、辦公條件的改善等)和必要的勞務(wù)開(kāi)支。
第三章 組建與換屆
第十條 首次組建倫理委員會(huì)成員由醫(yī)院院委會(huì)推薦�,醫(yī)藥相關(guān)專業(yè)技術(shù)人員在醫(yī)院各專業(yè)專家中選取,其它人員依據(jù)國(guó)家《臨床試驗(yàn)質(zhì)量管理規(guī)范》和《臨床試驗(yàn)倫理委員會(huì)工作指導(dǎo)原則》有關(guān)倫理委員會(huì)組成人員的規(guī)定,由醫(yī)院決定�,所有成員以醫(yī)院正式文件形式任命。
第十一條 倫理委員會(huì)設(shè)主任委員一名���,副主任委員一名���,由倫理委員會(huì)委員選舉產(chǎn)生。
第十二條 倫理委員會(huì)設(shè)倫理秘書(shū)一名��,負(fù)責(zé)受理倫理審查項(xiàng)目���、安排會(huì)議日程、會(huì)議記錄�����、決議通告��、檔案管理及其他日常工作。
第十三條 倫理委員會(huì)根據(jù)所審查試驗(yàn)項(xiàng)目的需要�,可聘請(qǐng)獨(dú)立顧問(wèn),獨(dú)立顧問(wèn)不參與投票�,僅對(duì)所審查項(xiàng)目發(fā)表專業(yè)意見(jiàn)。
第十四條 每屆倫理委員會(huì)組成人員不少于10人����,且性別均衡,任期五年�,到期換屆,可連選連任�����。換屆采取公開(kāi)征集或由當(dāng)屆委員推薦備選人員���,最終名單由當(dāng)屆倫理委員討論決定����,以會(huì)議紀(jì)要形式確定�����,醫(yī)院正式文件任命。
第十五條 倫理委員會(huì)主任委員可根據(jù)委員的工作表現(xiàn)及倫理委員會(huì)發(fā)展的需求���,解聘或增補(bǔ)相關(guān)人員�,解聘或增補(bǔ)均需要超過(guò)全體委員的半數(shù)人員同意后方可正式解聘或聘任��。
第四章 工作程序
第十六條 倫理委員會(huì)應(yīng)本著獨(dú)立����、公正、科學(xué)的原則開(kāi)展倫理審查工作�,不得受任何不利于受試者保護(hù)的因素影響。倫理委員會(huì)應(yīng)遵循《藥物臨床試驗(yàn)質(zhì)量管理規(guī)范》(GCP)和世界醫(yī)學(xué)會(huì)《赫爾辛基宣言》����、國(guó)際醫(yī)學(xué)科學(xué)組織理事會(huì)《涉及人的生物醫(yī)學(xué)研究國(guó)際倫理準(zhǔn)則》等相關(guān)的國(guó)際倫理準(zhǔn)則,在進(jìn)行臨床試驗(yàn)倫理審查時(shí)��,要以確保受試者的權(quán)益��、安全和健康高于對(duì)科學(xué)和社會(huì)利益的需求為目標(biāo)���。
第十七條 倫理委員會(huì)全體成員必須遵守衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)管理制度和工作流程���,認(rèn)真、自覺(jué)履行崗位職責(zé)���,積極參加倫理委員會(huì)安排的會(huì)議�,不得無(wú)故缺席����、遲到、早退����。并同意公開(kāi)其姓名、職業(yè)和隸屬關(guān)系���,簽署有關(guān)審查項(xiàng)目�、受試者信息和相關(guān)事宜的保密協(xié)議����,利益沖突聲明。
第十八條 本院牽頭或參與的所有臨床試驗(yàn)���,須取得倫理委員會(huì)的會(huì)議審查同意并簽署批準(zhǔn)意見(jiàn)后方可實(shí)施���,已批準(zhǔn)通過(guò)后進(jìn)行方案修訂需根據(jù)修訂情況待倫理委員會(huì)會(huì)議審查或快速審查或備案完成后方可執(zhí)行修訂后的方案�����。
第十九條 申請(qǐng)��、受理��、評(píng)議���、審定、下達(dá)衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)批復(fù)均應(yīng)遵循衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)標(biāo)準(zhǔn)操作規(guī)程�����,且需要履行書(shū)面手續(xù)�����。
第二十條 倫理委員會(huì)的審查形式有:會(huì)議審查和快速審查�����。按審查內(nèi)容可分為:初始審查���、復(fù)審審查��、跟蹤審查���、方案修訂審查、安全性報(bào)告審查���、方案偏離審查等�����。
第二十一條 會(huì)議審查時(shí)����,要求到會(huì)委員數(shù)應(yīng)不少于總委員人數(shù)的三分之二���,否則視為無(wú)效����。
第二十二條 審評(píng)過(guò)程要嚴(yán)格保密����,倫理委員會(huì)所有人員在受聘時(shí)均應(yīng)簽署保密協(xié)議。
第二十三條 會(huì)議審查后�,倫理委員會(huì)秘書(shū)及時(shí)整理會(huì)議記錄�,并根據(jù)會(huì)議記錄和審查意見(jiàn)形成書(shū)面?zhèn)惱韺彶橐庖?jiàn)/批件����。
第二十四條 倫理委員會(huì)主任委員簽發(fā)倫理審查批件/意見(jiàn),加蓋倫理委員會(huì)公章����。對(duì)于否定性的決議,應(yīng)有明確的解釋��。
第二十五條 倫理委員會(huì)的審查意見(jiàn)有以下幾種:
(一) 同意�;
(二) 作必要修改后同意;
(三) 不同意�����;
(四) 終止或暫停已經(jīng)批準(zhǔn)的臨床試驗(yàn)���。
第二十六條 倫理委員會(huì)主任委員主持倫理審查工作���,簽發(fā)倫理批件。主任委員不在時(shí)�,由副主任委員代行主任委員職權(quán)。
第二十七條 倫理委員會(huì)成員應(yīng)積極參加倫理審查會(huì)議����,認(rèn)真履行其職責(zé)�。每個(gè)委員每年參加的倫理審查會(huì)議次數(shù)若少于全年會(huì)議的1/3����,視為自動(dòng)放棄其委員資格,第二年則不再聘其為倫理委員會(huì)委員����。
第二十八條 委員會(huì)例會(huì)每半年一次�����,遇重要事項(xiàng)由主任臨時(shí)召開(kāi)��。
第二十九條 倫理委員會(huì)應(yīng)根據(jù)衡陽(yáng)市衛(wèi)健委的管理要求每年向市衛(wèi)健委報(bào)告上年度倫理審查工作情況�����。
第三十條 倫理委員會(huì)成員不得向其所審查的臨床試驗(yàn)的利益相關(guān)者索取現(xiàn)金�����、有價(jià)證券和禮品等任何不正當(dāng)?shù)慕?jīng)濟(jì)利益�。
第五章 附則
第三十一條 本章程的標(biāo)準(zhǔn)操作規(guī)程另行制定�����。
第三十二條 本章程自2021年7月 27日起執(zhí)行�����。
第三十三條 本章程由衡陽(yáng)市中心醫(yī)院臨床試驗(yàn)倫理委員會(huì)負(fù)責(zé)解釋�。